El 5 de juliol, Novo Nordisk va llançar un assaig clínic de fase III de la injecció de CagriSema a la Xina, el propòsit del qual és comparar la seguretat i l'eficàcia de la injecció de CagriSema amb la semeglutida en pacients obesos i amb sobrepès a la Xina.
La injecció de CagriSema és una teràpia combinada d'acció llarga que està desenvolupant Novo Nordisk, els components principals són l'agonista del receptor GLP-1 (pèptid semblant al glucagó-1) smeglutide i un anàleg d'amilina cagrilintide d'acció prolongada.La injecció de CagriSema es pot administrar per via subcutània un cop per setmana.
L'objectiu principal era comparar CagriSema (2,4 mg/2,4 mg) amb semeglutida o placebo una vegada per setmana per via subcutània.Novo Nordisk ha anunciat els resultats d'un assaig de CagriSema per al tractament de la diabetis en fase 2, que va demostrar que l'efecte hipoglucèmic de CagriSema és millor que el de la semeglutida, i gairebé el 90% dels subjectes han assolit l'objectiu d'HbA1c.
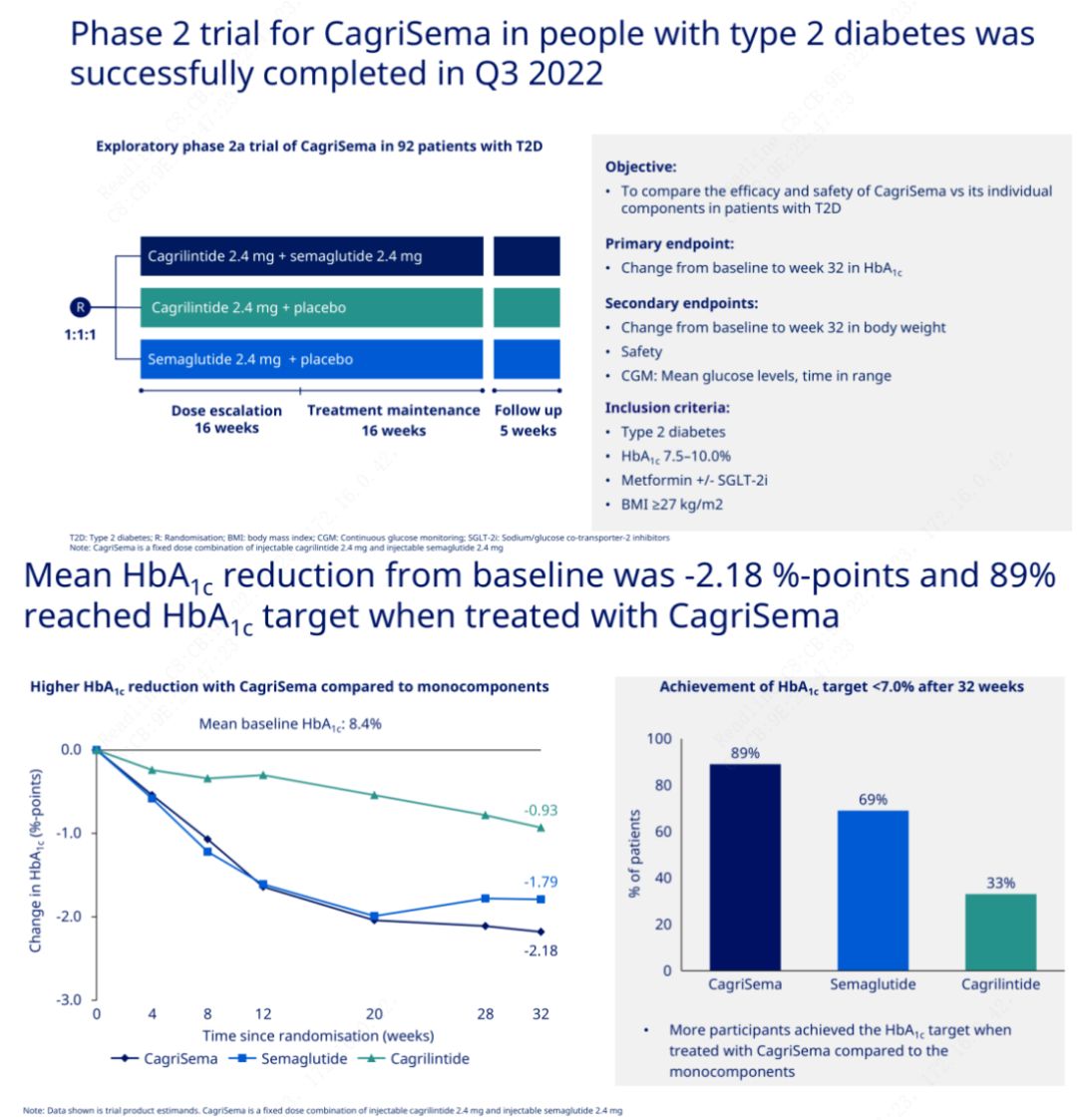
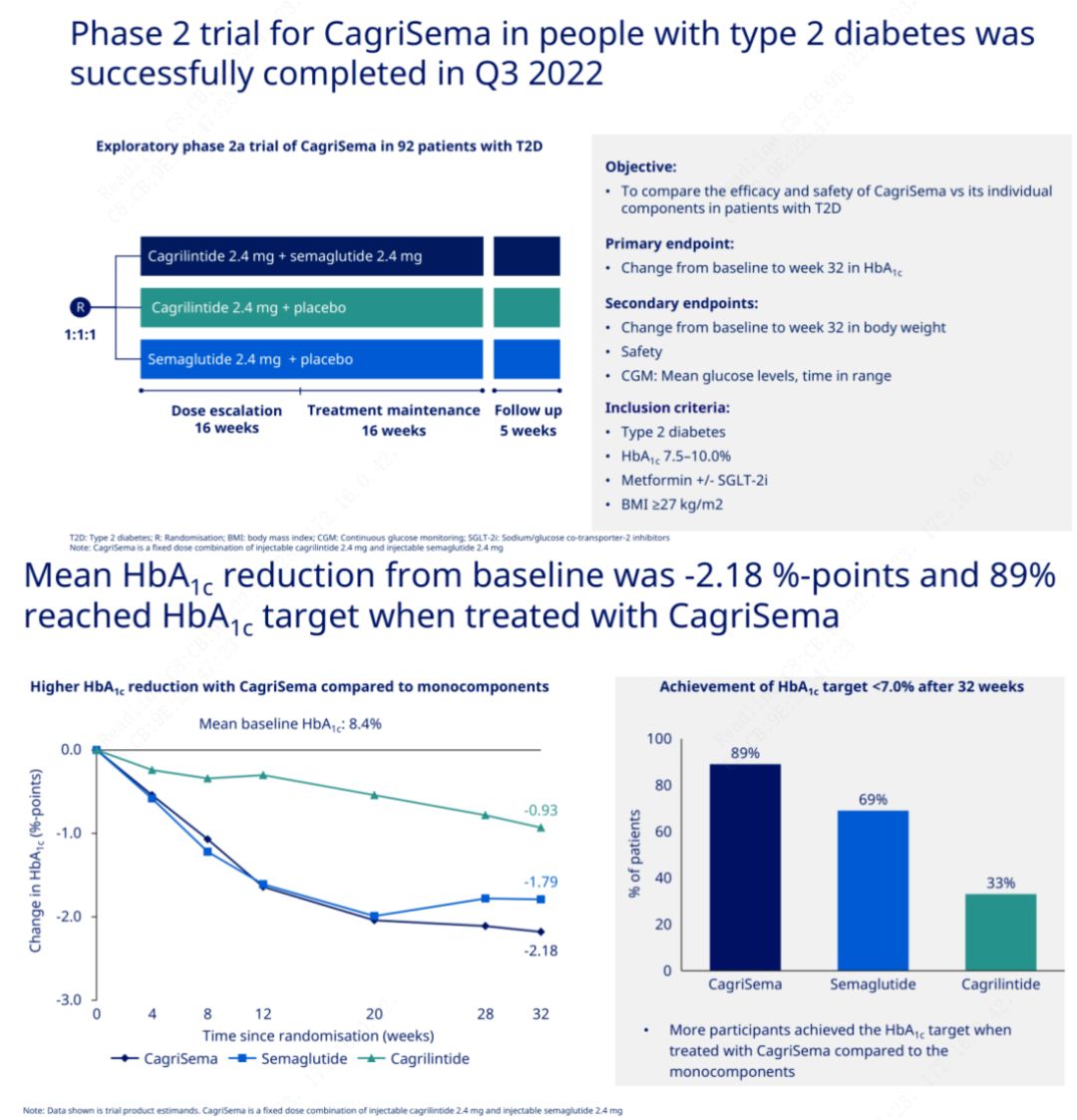
Les dades van mostrar que, a més de l'efecte hipoglucèmic significatiu, en termes de pèrdua de pes, la injecció de CagriSema va superar significativament la semeglutida (5,1%) i la cagrilintida (8,1%) amb una pèrdua de pes del 15,6%.
El fàrmac innovador Tirzepatide és el primer agonista del receptor GIP/GLP-1 setmanal aprovat del món.Combina els efectes de dues incretines en una sola molècula que s'injecta un cop per setmana i és una nova classe de tractaments per a la diabetis tipus 2.La tirzepatida va ser aprovada per la Food and Drug Administration (FDA) dels EUA el maig de 2022 per millorar el control glucèmic (sobre una base dietètica i exercici) en adults amb diabetis tipus 2 i actualment està aprovada a la Unió Europea, Japó i altres països.
El 5 de juliol, Eli Lilly va anunciar un estudi de fase III SURPASS-CN-MONO sobre el registre d'assaigs clínics de fàrmacs i la plataforma de divulgació d'informació per al tractament de pacients amb diabetis tipus 2.SURPASS-CN-MONO és un estudi de fase III aleatoritzat, doble cec i controlat amb placebo dissenyat per avaluar l'eficàcia i la seguretat de la monoteràpia amb tirzepatida en comparació amb el placebo en persones amb diabetis tipus 2.L'estudi preveia incloure 200 pacients amb diabetis tipus 2 que no prenguessin cap fàrmac antidiabètic durant els 90 dies anteriors a la visita 1 (excepte en determinades situacions clíniques, com ara malaltia aguda, hospitalització o cirurgia electiva, a curt termini (≤14). dies) ús d'insulina).
Es preveu que la diabetis tipus 2 estigui aprovada aquest any
El mes passat, els resultats d'un estudi SURPASS-AP-Combo es van publicar el 25 de maig a la revista de gran èxit Nature Medicine.Els resultats van mostrar que, en comparació amb la insulina glargina, Tirzepatide va mostrar una millor HbA1c i una reducció de pes a la població de pacients amb diabetis tipus 2 a la regió Àsia-Pacífic (principalment Xina): reducció de HbA1c de fins a un 2,49% i reducció de pes de fins a 7,2 kg. (9,4%) a les 40 setmanes de tractament, la millora significativa dels lípids a la sang i la pressió arterial, i la seguretat i la tolerabilitat generals van ser bones.
L'assaig clínic de fase 3 de SURPASS-AP-Combo és el primer estudi de Tirzepatide realitzat principalment en pacients xinesos amb diabetis tipus 2, dirigit pel professor Ji Linong de l'Hospital Popular de la Universitat de Pequín.SURPASS-AP-Combo és coherent amb els resultats de la sèrie global d'investigacions SURPASS, que demostra encara més que la fisiopatologia de la diabetis en pacients xinesos és coherent amb la dels pacients globals, que és la base per a la investigació i desenvolupament simultània de nous fàrmacs. a la Xina i al món, i també proporciona un suport d'evidència sòlida per donar als pacients xinesos l'oportunitat d'utilitzar els últims medicaments per al tractament de la diabetis i la seva aplicació clínica a la Xina tan aviat com sigui possible.
Hora de publicació: 18-set-2023

